为了防止蛋白质在细胞应激过程中受损,它们会聚集在所谓的应激颗粒中。马克斯普朗克生物化学研究所细胞生物化学系的科学家现在首次证明蛋白质Urm1在这一过程中发挥着关键作用。
在酵母细胞中,泛素样蛋白促进相分离的发生,从而促进应激颗粒的形成。该研究成果发表在《细胞》杂志上。
细胞可能会经历各种压力条件,例如发烧时的热应激。此类条件会损害蛋白质——这些分子负责几乎所有生命过程。细胞发起防御性应激反应的能力对其生存至关重要。
作为这种反应的一部分,小蛋白泛素附着在受损蛋白质上,发出信号,表示应通过降解将其去除。然而,其他蛋白质在应激过程中必须通过所谓的应激颗粒来保护它们,这一过程称为相分离。
目前还不清楚这一过程的具体原理。在最近的一项研究中,LucasCairo、Sae-HunPark及其同事描述了小蛋白Urm1在压力下调节可逆凝聚物形成中的作用。
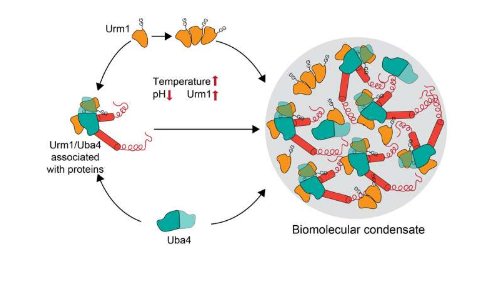
Urm1与泛素相关,并且像泛素一样可以共价附着于靶蛋白。然而,与泛素不同,Urm1的细胞作用尚未完全了解。研究人员发现,压力会触发Urm1与靶底物的共价附着,促进它们组装成应激颗粒和其他生物分子凝聚物。这使得它们能够安全储存,直到压力消退。
更具体地说,Urm1通过增强有利于这一生物物理过程的蛋白质-蛋白质相互作用来促进相分离的启动。其中的关键是Urm1能够感知压力下发生的细胞环境酸化。因此,Urm1通过多价相互作用与其他蛋白质发生相互作用和关联,形成复杂的蛋白质相互作用网络。
该网络促进蛋白质在细胞质和细胞核中的凝聚物中沉积。Urm1与靶蛋白的附着由酶Uba4促进,酶Uba4与Urm1在凝聚物中共同组装。如果没有Urm1,细胞就无法再应对压力。这些发现表明Urm1是一种泛素样蛋白,在细胞应激反应中起着关键作用。
