一些抗癌药物由于效果不够准确而导致严重的副作用。维尔茨堡大学生物化学家卡罗琳·基斯克(CarolineKisker)领导的团队现已发现了其中的原因。
小蛋白泛素参与了我们体内几乎所有的细胞过程:它协调绝大多数蛋白质的稳定性和功能。当它与其他蛋白质结合时,这些蛋白质通常会被释放并降解。然而,这种标记也可以被特殊的酶逆转。例如,酶28已知可以稳定对细胞生长和分裂很重要的蛋白质——这些蛋白质也可以在癌症生长中发挥重要作用。
为了降低这些蛋白质的稳定性,从而抑制癌症生长,人们开发了28抑制剂。这些抑制剂是目前正在开发的许多抗癌药物的基础,它们通过阻断28酶来破坏细胞分裂。问题是,它们通常不仅作用于28,还作用于25,后者是一种密切相关的酶,可将泛素与其他蛋白质分开,被认为是免疫系统的关键蛋白质。
因此,将28抑制剂进一步开发为可用于临床的治疗药物非常困难,因为它具有可预见的副作用——从胃肠道问题到神经损伤甚至自身免疫性疾病。
维尔茨堡大学(JMU)的研究人员现已发现,为什么抑制剂不仅针对28,还针对25。“显然,28和25之间很容易混淆,”维尔茨堡鲁道夫·维尔乔中心结构生物学主席兼研究和青年科学家副总裁CarolineKisker解释道。
“我们已经能够证明这两种酶在许多方面非常相似甚至相同,包括抑制剂起作用的确切位置。”
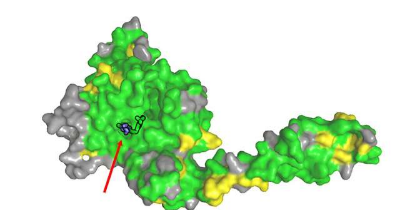
作为其研究的一部分,该生物化学家的团队使用X射线晶体学分析了28与三种抑制剂“AZ1”、“Vismodegib”和“FT206”的结合结构,从而确定了空间结合位点。
对25进行的进一步生化实验表明,抑制剂与28和25的结合位点相同。“因此,抑制剂无法区分它们的结合位点,”Kisker说。“这解释了非特异性效应。”
这一发现为精准抑制剂的开发铺平了道路
这项新科学发现为寻找更有效、副作用更小的药物提供了重要基础。开发这些药物是维尔茨堡研究人员的下一个主要目标。
“我们的结构生物学数据使我们能够修改现有的抑制剂,使它们只对25或28起作用,”Kisker说。“我们还想寻找与不太相似的酶位点结合的抑制剂。这将使这些分子具有更高的靶向精度。”
