嵌合抗原受体 (CAR) 是合成的膜蛋白,使淋巴细胞能够识别靶细胞的特定抗原并对其做出反应。尽管CAR-T细胞疗法在治疗B细胞淋巴瘤或白血病方面具有令人印象深刻的疗效,但昂贵且复杂的制造过程阻碍了其广泛的临床应用。
先前的研究已经探索了使用纳米粒子来传递核酸以对体内循环T细胞进行编程,简化CAR-T细胞的生成并避免从患者体内分离T细胞的需要。同时,将CAR蛋白直接插入T细胞膜可以提供一种简单的方法,避免细胞因子释放综合征(CRS)等并发症以及与随机病毒基因插入基因组相关的致瘤风险。
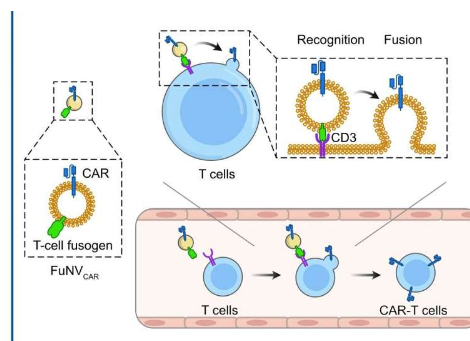
在华南理工大学生物医学科学与工程学院王军教授和徐丛飞教授的带领下,研究人员开发了一种有前景的策略,涉及预表达在融合纳米囊泡上的 CAR 分子的直接融合(FuNVs) 到 T 细胞,从而在体内构建 CAR-T 细胞。
他们通过向呼肠孤病毒或麻疹病毒融合剂中添加抗 CD3 单链可变片段来设计 T 细胞融合剂。他们证明,源自表达 T 细胞融合剂的细胞的 FuNV 携带大量 T 细胞融合剂,可在体外和体内有效诱导 NV 与 T 细胞之间的融合。
随后,考虑到抗CD19(αCD19)CAR-T细胞的临床成功,构建了表达T细胞融合剂和αCD19 CAR蛋白的工程细胞,以产生携带αCD19 CAR的FuNV(FuNV CAR)。通过 FuNV CAR在体外和体内将 CAR 蛋白递送到 T 细胞上,成功实现了 CAR-T 细胞生产。同时,静脉注射FuNV CAR有效抑制B细胞淋巴瘤的生长。
为了进一步探讨FuNV CAR的潜在毒性,在第2天和第14天进行了血细胞计数和血清生化分析,证明了与对照组的可比性。在使用 FuNV CAR治疗的整个过程中,没有观察到小鼠体重的显着变化。
此外,与传统的 CAR-T 细胞治疗相比,FuNV CAR治疗不会诱导炎症细胞因子的释放增加。这种观察到的差异可归因于 FuNV CAR产生的瞬时 CAR-T 细胞,该细胞经历有限和暂时的激活,从而减轻炎症细胞因子的持续释放。
总之,本研究介绍了一种通过 FuNV 介导的 CAR 蛋白递送体内 CAR-T 细胞生产的新方法。然而,值得注意的是,这种策略可能不适合 T 细胞功能受损的患者。
