生物细胞包含内置的“管家”机制,用于处理受损的细胞结构。这包括泛素蛋白酶体系统(UPS),它选择性地用泛素分子标记不需要的蛋白质,然后清除它们。当UPS机制失效时,细胞会激活一种称为“聚集吞噬”的补偿性蛋白质清除过程,其中蛋白质聚集体被细胞以受控方式降解。然而,迄今为止,聚集吞噬背后的机制尚不清楚。
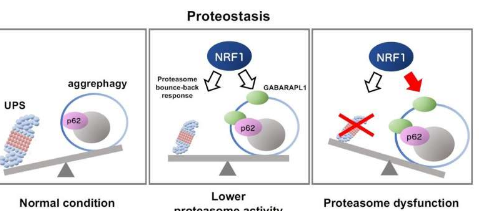
现在,《科学报告》上发表的一篇论文揭示了其潜在机制。该研究的第一作者、日本同志社大学研究生AtsushiHatanaka解释道:“我们的研究表明,转录因子NRF1(NFE2L1)会诱导聚集吞噬的激活,以应对蛋白酶体功能障碍。”
研究小组还包括同志社大学生命医学科学研究生院遗传密码实验室的中田苍太(SotaNakada)和小林彰(AkiraKobayashi)。
NRF1是一种参与DNA转录为RNA的蛋白质,在蛋白质的平衡和调节中发挥着关键作用。当蛋白酶体受损时,它会上调蛋白酶体基因。
作为研究的一部分,研究小组首先使用小干扰RNA(siRNA)来降低细胞模型中NRF1合成基因的活性。然后他们使用抑制剂MG132来阻断蛋白酶体介导的蛋白质循环。这些治疗导致细胞模型中不需要的蛋白质积累,表明NRF1的缺失有效抑制了聚合吞噬激活,而聚合吞噬激活通常在细胞中普遍存在。
研究人员随后检查了蛋白酶体抑制对NRF1直接靶标基因的影响。在实验过程中,研究小组注意到,为了应对蛋白酶体失败,NRF1导致自噬相关基因p62和GABARAPL1水平增加。
相应蛋白质p62和GABARAPL1水平的升高导致被管家蛋白泛素标记为去除的蛋白质被去除。换句话说,NRF1被发现通过p62和GABARAPL1触发聚合吞噬过程,作为对蛋白酶体衰竭的直接生理反应。
接下来,研究小组还发现,NRF1的存在对于p62阳性点的形成是必要的,p62点是装载大量蛋白质p62的微小圆形细胞结构。此外,很明显,p62、ULK1和TBK1蛋白的共定位(物理接近)对于p62的激活是必要的。蒂
s的激活被认为是磷酸化的直接结果——向蛋白质添加磷酸基团。一系列实验表明,NRF1促进了p62的磷酸化。磷酸化的p62随后促进了聚集吞噬过程。如前所述,在NRF1介导的GABARAPL1蛋白水平增加后,也观察到类似的聚集性增加。
Hatanaka先生在解释这项研究的新颖性时说,“虽然之前已证明NRF1在蛋白酶体功能障碍时上调蛋白酶体基因,但我们的全基因组转录组分析表明,NRF1直接上调自噬相关基因p62和GABARAPL1。”
这些发现为开发针对退行性疾病的新疗法铺平了道路,例如阿尔茨海默病、帕金森病和路易体痴呆——所有这些疾病都是由错误折叠蛋白质的积累引起的。
