金泽大学的研究人员在NanoLetters中报告了高速原子力显微镜如何深入了解与阿尔茨海默病相关的过程。此外,该技术被证明是研究药物对疾病影响的极好工具。
根据淀粉样蛋白假说,阿尔茨海默氏病(最常见的痴呆症类型)是由大脑中淀粉样蛋白(Aβ)的产生、积累和处置缺陷引起的。Aβ是指一组肽(蛋白质片段),随着时间的推移会在阿尔茨海默病患者的大脑中形成斑块。旨在减少Aβ聚集的药物已经开发出来,但最近的研究结果表明,不同类型的Aβ聚集体对阿尔茨海默病的发展有不同的贡献。
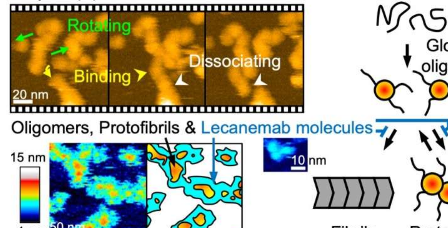
特别是,中间聚集体(如原纤维)比实际的最终原纤维(Aβ斑块的主要成分)毒性更大。因此,准确了解复杂的聚集途径对于进一步开发有效的抗阿尔茨海默氏病药物是必要的。来自金泽大学的KenjiroOno及其同事现已成功地可视化原纤维的结构动力学,以及最近开发的基于抗Aβ抗体的药物的作用。
科学家们通过高速原子力显微镜(HS-AFM)观察了Aβ原纤维的形成和结构。后一种方法近年来已成为一种强大的纳米成像工具,用于在高时空分辨率下研究生物分子及其动力学。HS-AFM观察表明,原纤维具有节点结构,在多个样本中具有稳定的结构特征——特别是节点之间的结合角。重要的是,这种节点结构不同于具有螺旋结构的适当成熟原纤维。
Ono及其同事随后研究了原纤维的解离。他们发现原纤维的长度取决于它们的浓度,这表明聚集体可以自发解离。
为了详细了解抗Aβ抗体药物的功能,研究人员检查了Aβ原纤维与一种称为lecanemab的新药之间的结合。他们发现,lecanemab对原纤维的结合能力(亲和力)几乎与原纤维的大小无关——换句话说,亲和力在整个聚集过程中基本没有变化。HS-AFM观察进一步表明,lecanemab覆盖了小的前原纤维聚集体的表面。这样做时,该药物会抑制进一步聚集成原纤维,进而阻止适当的Aβ原纤维和斑块的形成。
Ono及其同事的结果提供了抗体药物干扰Aβ聚集过程的机制的直接证据。更一般地说,这项工作证实了HS-AFM方法在研究生化途径方面的多功能性。“单分子HS-AFM是揭示瞬态、亚稳态淀粉样蛋白聚集中间体的结构动力学以及抗聚集药物对其影响的有效工具,”研究人员表示。
高速原子力显微镜
原子力显微镜(AFM)的一般原理是使一个非常小的针尖扫描样品的表面。在此水平(xy)扫描期间,连接到小悬臂的尖端遵循样品的垂直(z)剖面,在悬臂上产生可测量的力。xy位置的力的大小可以与z值相关;然后,扫描期间生成的xyz数据生成高度图,提供有关所研究样本的结构信息。在高速原子力显微镜(HS-AFM)中,工作原理稍微复杂一点:悬臂在其共振频率附近振荡.当尖端围绕表面移动时,悬臂振荡的振幅(或频率)的变化——由尖端与样品表面的相互作用引起——被记录下来,因为这些提供了局部“z”值的度量。
HS-AFM生成视频,其中帧之间的时间间隔取决于生成单个图像的速度(通过xy扫描样本)。近年来,金泽大学的研究人员进一步开发了HS-AFM,使其可用于实时研究生化分子和生物分子过程。KenjiroOno及其同事现已应用该方法研究淀粉样蛋白-β原纤维的结构动力学,已知其在阿尔茨海默氏病的发病机制中起着至关重要的作用,以及抗淀粉样蛋白-β抗体药物对抗该疾病的作用.
